L-Alanina CAS: 56-41-7 99% pols cristal·lina blanca
| Número de catàleg | XD90326 |
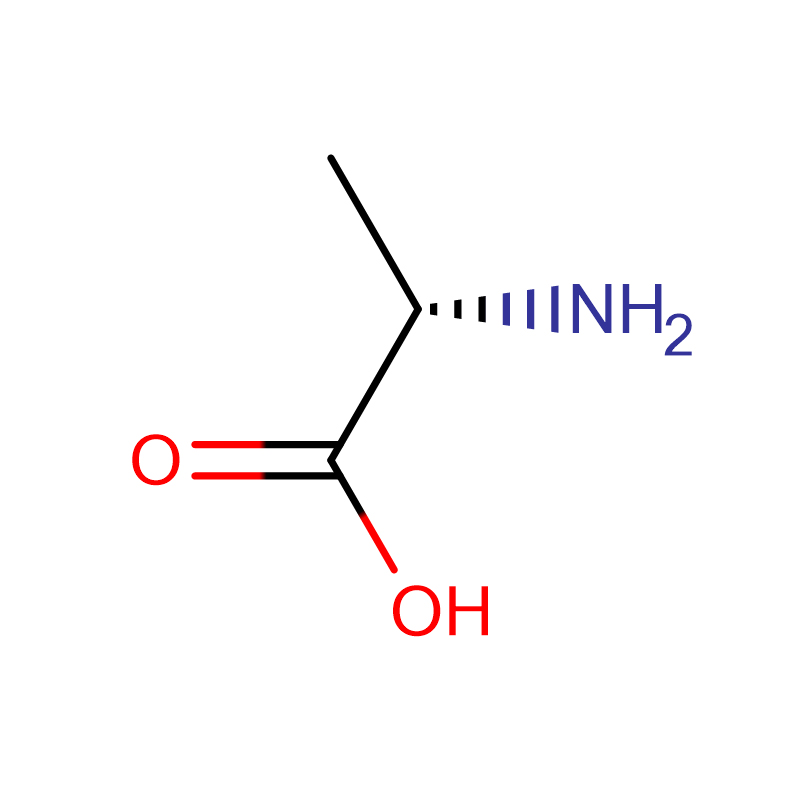
| nom del producte | D-Alanina |
| CAS | 338-69-2 |
| Fórmula molecular | C3H7NO2 |
| Pes molecular | 89.09 |
| Detalls d'emmagatzematge | Ambient |
| Codi Tarifari Harmonitzat | 29224985 |
Especificació del producte
| Aparença | Pols cristal·lí blanc |
| Assaig | 98,5-101,5% |
| Rotació específica | +13,7 a +15,1 |
| Metalls pesants | <0,0015% |
| pH | 5,5 - 7 |
| SO4 | <0,03% |
| Pèrdua en l'assecat | <0,2% |
| Ferro | <0,003% |
| Residus a l'encesa | <0,15% |
| Tamany de partícula | 200um |
| Cl | <0,05% |
| Nivell de contaminants orgànics persistents | Sense contaminants |
Les γ-glutamiltranspeptidases (γ-GTs) escinden l'enllaç γ-glutamil amida del glutatió i transfereixen el grup γ-glutamil alliberat a l'aigua (hidròlisi) o als aminoàcids acceptors (transpeptidació).Aquests enzims omnipresents tenen un paper clau en la biosíntesi i degradació del glutatió, i en la desintoxicació xenobiòtica.Aquí informem de l'estructura cristal·lina de resolució de 3Å de Bacillus licheniformis γ-GT (BlGT) i la del seu complex amb l-Glu.Les estructures de raigs X confirmen que BlGT pertany a la superfamília de la hidrolasa nucleòfila N-terminal i revelen que la proteïna posseeix una escletxa del lloc actiu obert similar a la que es va informar per a l'enzim homòleg de Bacillus subtilis, però diferent de les observades per a γ-GT i humans. per a γ-GT d'altres microorganismes.Les dades suggereixen que la unió de l-Glu indueix una reordenació de la cua C-terminal de la subunitat gran BlGT i permet la identificació d'un grup de residus àcids que estan potencialment implicats en el reconeixement d'un ió metàl·lic.El paper d'aquests residus en l'estabilitat conformacional de BlGT s'ha estudiat caracteritzant l'autoprocessament, l'activitat enzimàtica, la desnaturalització química i tèrmica de quatre nous mutants únics d'Ala.Els resultats mostren que la substitució d'Asp568 per un Ala afecta tant l'autoprocessament com l'estabilitat estructural de la proteïna.